吉美瑞生联合多家单位发表《呼吸系统干细胞临床研究进展》综述
发布时间:19/02/28在我国,呼吸系统疾病的发生率正处于急速攀升的态势。加之许多呼吸系统疾病的发生和发展是不可逆的,医学界目前对于这些不可逆的呼吸系统病变尚无有效的治疗手段,同时,这也给社会带来了巨大的经济负担。因此,对于急性和慢性肺部损伤及修复的研究和临床防控研究非常必要,呼吸系统疾病的防治形势也变得相当严峻。对于各种类型的急性和慢性肺部疾病,传统的治疗方法并没有取得特别良好的效果。而以干细胞治疗为代表的新技术,则为这些疾病的治疗提供了新的思路和方案。
2019年1月17日,苏州吉美瑞生医学科技有限公司马煜博士,中华医学会呼吸病学分会候任主任委员、上海交通大学医学院附属瑞金医院瞿介明教授和同济大学附属上海市肺科医院、广州医科大学呼吸疾病国家重点实验室左为教授合作在《中国细胞生物学学报》在线发表题为《呼吸系统干细胞临床研究进展》的综述,文中对于已报道的间充质干细胞治疗呼吸系统疾病的临床研究进行了概括和分析,同时也详细介绍了目前已经发现的成体肺内的两大类肺干细胞,并对自体支气管基底层细胞在临床治疗呼吸系统疾病研究中的相关进展进行了具体而全面的总结。

1 早期间充质干细胞在呼吸系统疾病治疗中的探索
早期用于细胞治疗的细胞多为间充质干细胞。在呼吸系统疾病的治疗方面,间充质干细胞已经被用于多种慢性和急性呼吸系统损伤的临床研究,其中部分研究已经完成并报道了研究结果。目前已有关于间充质干细胞治疗COPD(包含肺气肿)(NCT01110252和NCT01306513)、IPF(NCT01385644)、急性呼吸窘迫综合征(NCT01775774)等的临床研究的结果报道显示,间充质干细胞的移植对于呼吸系统损伤疾病的治疗具有较好的安全性,但在功能方面并未表现出较好的疗效[1-5]。在间充质干细胞之外寻找到真正具有肺组织分化潜能的干细胞并将其用于移植治疗,将成为今后呼吸系统疾病细胞治疗的关键所在。
2 肺干细胞的分类及再生修复机制
总体上来看,可以将肺干细胞或肺前体细胞分为二型肺泡上皮细胞(alveolar epithelial type 2 cell,AEC2)和支气管基底层细胞(basal cell)两个大类。
在体外三维培养条件下,AEC2来源的肺前体细胞可以分化成为一型肺泡上皮及二型肺泡上皮细胞。在小鼠体内的谱系踪试验也证实这些细胞可以在动物体内分化成为成熟的肺泡上皮细胞[6-8]。然而,由于缺乏体内移植数据,目前尚不明确人体内的这类AEC2是否具有再生肺泡的能力[6-8]。由于AEC2分布位置在远端肺实质区域,它主要在肺部日常自稳态维持和轻微损伤修复中发挥作用。当肺实质出现大规模损伤之后,AEC2本身的死亡导致它难以发挥出再生修复的功能。
当肺部出现大规模损伤之后,位于近段气道的支气管基底层细胞担负起修复再生肺组织的任务。支气管基底层细胞包含远端气道干细胞(distal airway stem cell,DASC),它是在动物和人体支气管上皮底层位置天然存在的一类特殊的细胞,特异表达Krt5和 P63标记基因。这类细胞具有多种分化潜能。一方面,它可以在支气管内分化成为分泌细胞和纤毛细胞,修复再生支气管上皮;另一方面,这类细胞可以感知远端肺实质的损伤,进而被激活从近段沿支气管迁移进入肺实质,完成肺实质的损伤修复[9-11]。
就目前来看,支气管基底层细胞在培养和移植方面的优势使其在临床应用上有更高的潜力,有望通过新生肺部结构,修复肺的损伤,重建肺部的生理功能,从而达到疾病治疗的目的。同时为目前尚无有效治疗手段的肺损伤疾病(如IPF、COPD、支气管扩张等)治疗提供新的思路和新的希望。
3 支气管基底层细胞临床应用研究现状
目前在美国国立卫生研究院 (National Institute of Health,NIH)临床研究官方数据库Clinicaltrials上可以查询到已经登记的相关临床研究,其中包含支气管扩张、COPD和间质性肺病 (interstitial lung disease)的临床研究(表1)。
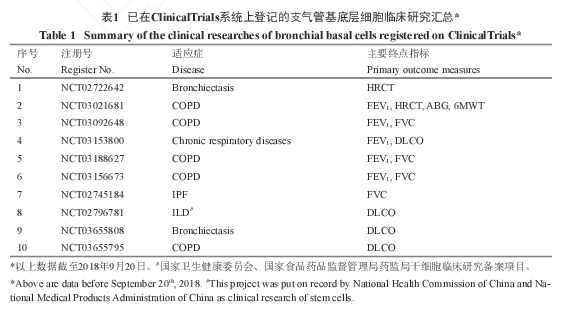
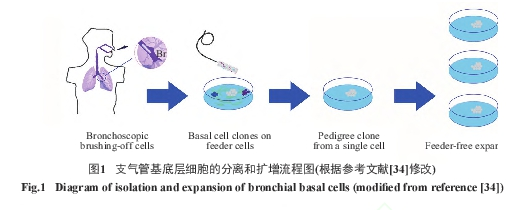
以上注册应用临床研究的支气管基底层细胞的移植均为自体细胞移植, 即利用稳定的工艺从患者自体分离出支气管基底层细胞之后,在体外大量扩增,制备成临床级的人支气管基底层细胞自体回输制剂(图1)。
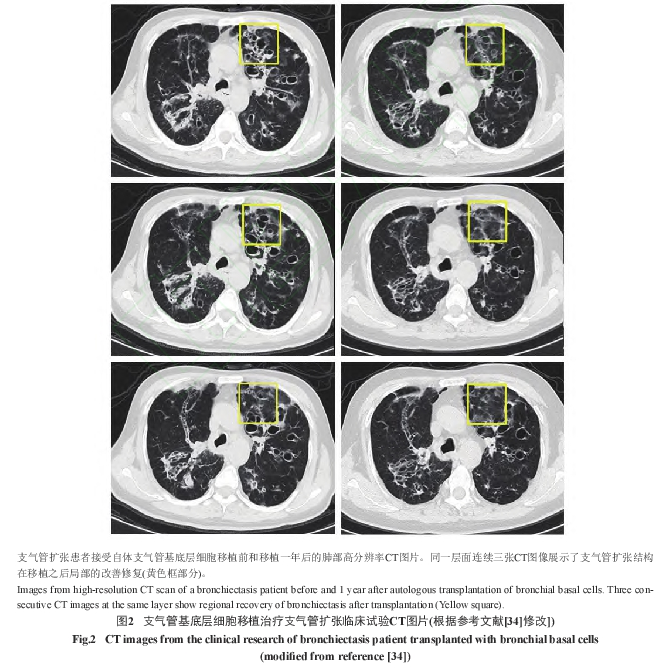
2018年,研究者[12]率先报道了首个支气管基底层细胞移植的临床研究,适应症为支气管扩张。支气管扩张是由慢性炎症反应引起,支气管结构发生进行性的损伤,支气管的弹性组织被破坏,支气管发生持久扩张,目前利用传统方法并无有效的治疗手段,结构上的损伤无法得到恢复[13-14]。在这个小样本探索性研究中,2名约50岁的男性非囊性纤维化支气管扩张患者在2016年4月被招募参与自体支气管基底层细胞移植。研究者通过支气管镜刷检获取2名患者的刷检组织,之后在GMP规范的环境中,从这2名支气管扩张患者的刷检组织中成功分离和扩增支气管基底层细胞,再通过支气管镜将临床级的自体支气管基底层细胞按1×106 个细胞/kg体重的剂量分别回输到两名患者的远端肺叶。在细胞回输前1天,细胞回输后1月、3月和12月分别对患者的临床状态进行评估,同时对患者进行持续跟踪到细胞回输后20个月,结果显示,2名患者未发生不良反应。细胞移植后患者的肺功能检测中FEV1、FVC和DLCO/VA指标明显恢复。CT的结果也显示,其中1名患者的支气管囊性扩张发生区域性的修复(图2),同时患者自述呼吸困难的症状改善,运动能力增强,咳嗽减少,急性加重的次数也减少;另1名患者也明显感受到咳嗽减少和急性加重次数减少[12]。因此,自体支气管基底层细胞在支气管扩张的治疗中显示出有效的迹象,为临床研究的进一步探索提供了坚实的基础。
结合科学理论和现有实验数据来看,相比间充质干细胞移植,以支气管基底层细胞为代表的成体肺干细胞移植在呼吸系统疾病治疗方面整体上具有较明显的优势。支气管基底层细胞移植在修复呼吸系统损伤中具有很高的可能性。支气管基底层细胞移植为呼吸系统疾病的临床治疗提供了新的潜在方法。
原文链接:
http://kns.cnki.net/kcms/detail/31.2035.Q.20190117.1628.002.html
1 Ribeiro-Paes JT, Bilaqui A, Greco OT, Ruiz MA, Marcelino MY, Stessuk T, et al. Unicentric study of cell therapy in chronic obstructive pulmonary disease/pulmonary emphysema. Int J Chron Obstruct Pulmon Dis 2011; 6: 63-71.
2 Weiss DJ, Casaburi R, Flannery R, LeRoux-Williams M, Tashkin DP. A placebo-controlled, randomized trial of mesenchymal stem cells in COPD. Chest 2013; 143: 1590-8.
3 Stolk J, Broekman W, Mauad T, Zwaginga JJ, Roelofs H, Fibbe WE, et al. A phase I study for intravenous autologous
mesenchymal stromal cell administration to patients with severe emphysema. QJM 2016; 109(5): 331-6.
4 Chambers DC, Enever D, Ilic N, Sparks L, Whitelaw K, Ayres J, et al. A phase 1b study of placenta-derived mesenchymal stromal cells in patients with idiopathic pulmonary fibrosis. Respirology 2014; 19(7): 1013-8.
5 Wilson JG, Liu KD, Zhuo H, Caballero L, McMillan M, Fang X, et al. Mesenchymal stem (stromal) cells for treatment of ARDS: a phase 1 clinical trial. Lancet Respir Med 2015; 3(1): 24-32.
6 Barkauskas CE, Cronce MJ, Rackley CR, Bowie EJ, Keene DR, Stripp BR, et al. Type 2 alveolar cells are stem cells in adult lung. J Clin Invest 2013; 123(7): 3025-36.
7 Zacharias WJ, Frank DB, Zepp JA, Morley MP, Alkhaleel FA, Kong J, et al. Regeneration of the lung alveolus by an evolutionarily conserved epithelial progenitor. Nature 2018; 555(7695): 251-5.
8 Nabhan AN, Brownfield DG, Harbury PB, Krasnow MA, Desai TJ. Single-cell Wnt signaling niches maintain stemness of alveolar type 2 cells. Science 2018; 359: 1118-23.
9 Kumar PA, Hu Y, Yamamoto Y, Hoe NB, Wei TS, Mu D, et al. Distal airway stem cells yield alveoli in vitro and during lung regeneration following H1N1 influenza infection. Cell 2011; 147(3): 525-38.
10 Zuo W, Zhang T, Wu DZ, Guan SP, Liew AA, Yamamoto Y, et al. p63(+)Krt5(+) distal airway stem cells are essential for lung regeneration. Nature 2015; 517(7536): 616-20.
11 Vaughan AE, Brumwell AN, Xi Y, Gotts JE, Brownfield DG, Treutlein B, et al. Lineage-negative progenitors mobilize to regenerate lung epithelium after major injury. Nature 2015; 517(7536): 621-5.
12 Ma Q, Ma Y, Dai X, Ren T, Fu Y, Liu W, et al. Regeneration of functional alveoli by adult human SOX9(+) airway basal cell transplantation. Protein Cell 2018; 9(3): 267-82.
13 Wang Z. Bronchiectasis: still a problem. Chin Med J (Engl) 2014; 127(1): 157-72.
14 Chalmers JD, Aliberti S, Blasi F. Management of bronchiectasis in adults. Eur Respir J 2015; 45(5): 1446-62.