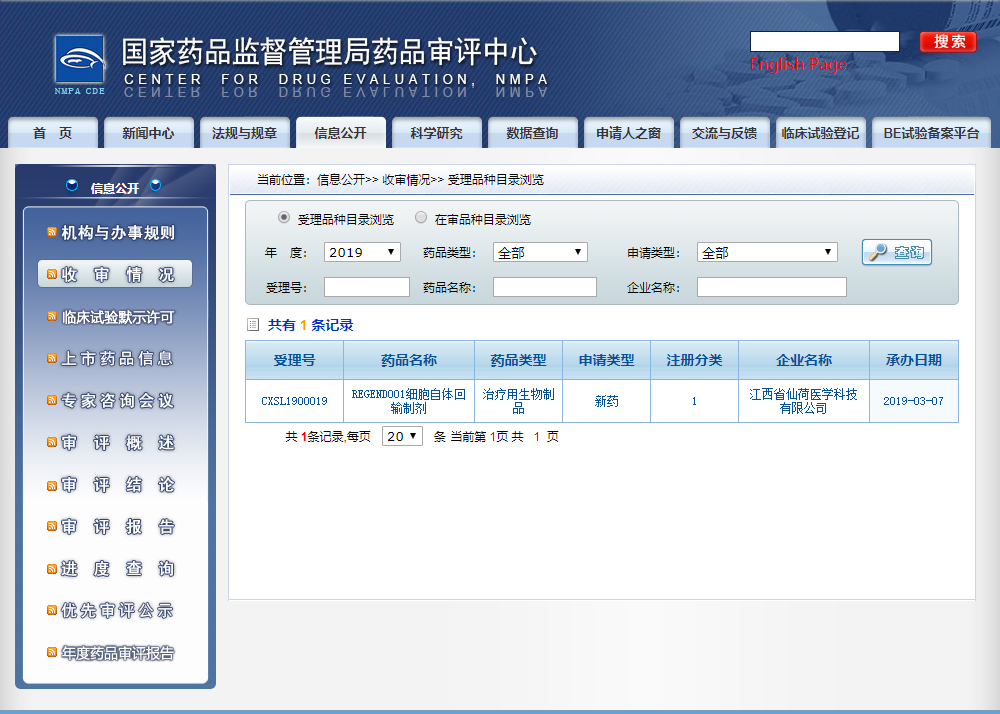
REGEND001新药临床获CFDA受理
发布时间:19/05/31近日,由吉美瑞生集团核心平台江西省仙荷医学科技有限公司自主研发的产品REGEND001细胞自体回输制剂的临床试验申请已被国家药品监督管理局药品审评中心受理,受理号为CXSL1900019。REGEND001细胞制剂是国内首个针对呼吸系统疾病的自体干细胞产品,是帮助呼吸系统再生的干细胞产品。
吉美瑞生于2015年7月成立,公司首席科学家由左为教授担任,是一家专注于人体器官再生医学业务的高科技公司。吉美瑞生是中国首个经国家卫健委、食药监局项目备案注册,准许开展干细胞临床研究的企业之一(注册号: CMR-20161214-1002);同时也是首批承接国家科技部重点研发计划"干细胞及转化研究"课题的企业。公司拥有分离、扩增上皮组织成体干细胞的专利技术,有望解决此类细胞分离、扩增的世界性难题。成果的一部分已发表在国际顶尖学术期刊《自然》上,并申请多项国家专利,“成体干细胞实现肺组织再生”的部分研究成果发表在《Protein&Cell》杂志上,该研究进展也当选2018年度“中国医药生物技术十大进展”。

基于多年的科研成果,吉美瑞生自主研发的REGEND001细胞自体回输制剂于2016年初启动了I/II期开放、历史对照的临床研究,初步评价自体支气管基底层细胞治疗慢阻肺、支扩、间质性肺病等的安全性及有效性,并于2018年初启动了带同期对照的临床研究,已与全国二十余家三甲医院合作开展了临床研究。
当前我国损伤、退行性疾病是人类健康的主要威胁之一,传统手段无法彻底治愈,仅能延缓病程发展,究其原因与尚无有效手段修复人体器官的结构损伤有关。新一代再生医学成体干细胞因其可以再现发育过程,使机体发育再生从而成为新的治疗方式,为这类疾病的治疗提供了新的思路。
为提高药品的质量、促进医药行业结构调整和转型升级,国家不断出台相关鼓励政策。2017年12月CFDA发布的 《关于调整药物临床试验审评审批的公告(征求意见稿)》,规定了限期完成审评审批的管理办法,再次强调了国家加快创新药物审评审批速度的决心。
REGEND001临床数据现已形成总结报告材料并递交,申请我国第一个针对肺部疾病的自体干细胞新药,药监局已经受理。
吉美瑞生此次干细胞新药的临床试验申请不仅仅是对过去几年研发过程的一个总结,更是新药上市应用前的一个新开始;未来不仅可以造福一大批患者,其产业化示范作用也将创造巨大的社会价值。